相关条件




服务指南
申请条件:
1.申报产品已确定为第二类体外诊断试剂,注册申请人为河南省省内企业;
2.按照有关规定取得企业营业执照或事业单位法人证书;
3.已具备拟注册产品的生产能力,并按照要求建立医疗器械注册质量管理体系;
4.已参照执行国家药品监督管理局已发布的相应技术指导原则。
5.已编制拟申请产品技术要求,完成注册检测;
6.已完成临床评价;
7.办理体外诊断试剂注册申请的人员具有相应的专业知识,熟悉医疗器械注册管理的法规、规章和有关的技术要求。
设定依据:
1、《医疗器械监督管理条例》(中华人民共和国国务院令第739号)第十六条:“申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。……”。
2、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)第九条:“……第二类、第三类医疗器械实行注册管理。……境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。……”
申请材料:
1 监管信息(第二类体外诊断试剂产品注册)
2 综述资料(第二类体外诊断试剂产品注册)
3 非临床资料(第二类体外诊断试剂产品注册)
4 临床评价资料(第二类体外诊断试剂产品注册)
5 产品说明书和标签样稿(第二类体外诊断试剂产品注册)
6 质量管理体系文件(第二类体外诊断试剂产品注册)
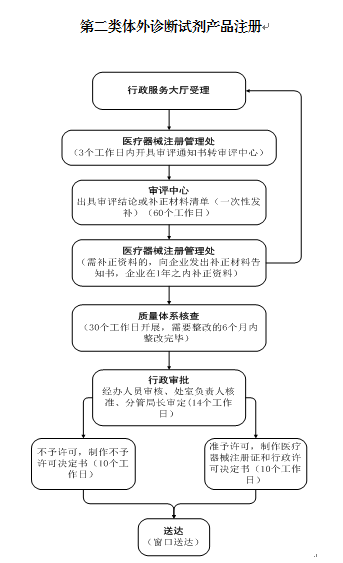
办理流程:
我们提供的服务






关键词
相关文章



























 18576401396
18576401396 







